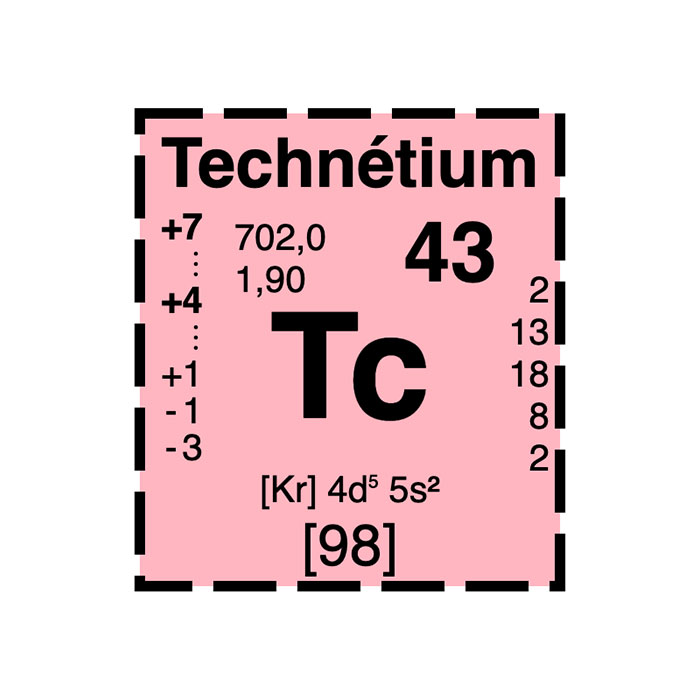
Production dans les déchets nucléaires
Le technétium 99 est une substance rare dans la nature, mais sa production annuelle est importante en tant que sous-produit de la fission du combustible nucléaire. Lorsqu’un gramme d’uranium 235 subit la fission dans un réacteur nucléaire, il produit 27 mg de 99Tc, soit un taux de production de 6,1 %. D’autres éléments fissiles tels que l’uranium 233 et le plutonium 239 présentent des taux de production similaires, respectivement de 4,9 % et de 6,21 %. Ils peuvent être utilisés pour produire du combustible nucléaire.
Principale source et coût
Selon les estimations, la production de technétium dans les réacteurs nucléaires a atteint environ 49 000 térabecquerels (TBq), soit 78 tonnes, jusqu’en 1994. Cette production représente sa principale source sur Terre. Toutefois, seule une infime partie du technétium est utilisée à des fins commerciales. Son coût d’achat en 2016 était d’environ 100 dollars par gramme, soit une baisse considérable par rapport aux 2 800 dollars par gramme enregistrés en 1960. Il coûte toutefois plus cher que le platine qui n’a jamais été à plus de 72,40 dollars par gramme.
Il se trouve dans les résidus radioactifs issus de la fragmentation de l’uranium 235 et du plutonium 239 ainsi que lors d’une explosion nucléaire. Le technétium produit artificiellement est présent en quantité bien supérieure à celui présent naturellement dans l’environnement. Cette production provient des essais nucléaires effectués dans l’atmosphère ainsi que du traitement et de la gestion des déchets nucléaires.
Problématiques liées à la gestion des déchets nucléaires
Le technétium 99 est considéré comme l’un des éléments les plus problématiques des déchets nucléaires en raison de sa forte radioactivité, de sa longue demi-vie et de sa volatilité. En effet, sa décroissance, mesurée en becquerels par unité de combustible usé, prédomine dans une plage de temps allant de 104 à 106 ans après la formation des déchets.
En 1994, des essais nucléaires en atmosphère ont libéré environ 250 kg de technétium 99 dans l’environnement, soit une quantité estimée à 160 TBq. En 1986, une grande quantité de cet élément, équivalente à approximativement 1 000 TBq (1 600 kg), a été produite par les réacteurs nucléaires. Cette substance a été libérée dans l’environnement principalement lors du traitement du combustible usé, avec des rejets dans la mer.
Avancées dans les techniques de retraitement
Ces dernières années, les avancées techniques dans le traitement des déchets radioactifs ont permis de minimiser les rejets de technétium 99 dans le milieu naturel. En 2005, le site de Sellafield était sa principale source de rejet dans l’environnement. Entre 1995 et 1999, approximativement 550 TBq (900 kg) ont été déversés dans la mer d’Irlande. Depuis les années 2000, une réglementation a été mise en place pour limiter les émissions à 90 TBq (140 kg) par an.
Les bactéries anaérobies sporulantes appartenant au genre Clostridium sont capables de réduire le technétium (Tc) de l’état Tc(VII) à Tc(IV). Cette capacité joue un rôle clé dans sa mobilité dans les déchets industriels et les environnements souterrains. Les clostridia peuvent également réduire le fer, le manganèse et l’uranium. Elles modifient ainsi leur solubilité dans les sols et les sédiments.
Défis de la gestion à long terme dans les déchets radioactifs
À l’instar de l’iode 129I, le technétium 99 présente des défis considérables pour la gestion à long terme des déchets radioactifs en raison de sa longue durée de vie et de sa tendance à former des espèces anioniques. De plus, de nombreux procédés utilisés dans les usines de retraitement pour éliminer les produits de fission visent à enlever les espèces cationiques telles que le césium 137Cs ou strontium 90Sr. Ainsi, il est impossible d’éliminer les ions pertechnétate à l’aide de ces procédés de retraitement.
Les options de traitement pour les déchets radioactifs se concentrent sur l’enfouissement en profondeur dans des couches géologiques. Cependant, cette méthode comporte un risque élevé de contamination de l’environnement en cas de contact avec l’eau. En effet, les anions pertechnétate et les ions iodure ont une faible capacité d’absorption sur les surfaces minérales. Ils sont donc plus susceptibles de se propager dans le milieu naturel.
Le technétium se distingue par sa faible affinité avec les particules du sol, contrairement à d’autres éléments tels que le plutonium, le césium et l’uranium. C’est la raison pour laquelle sa chimie environnementale suscite l’intérêt de la communauté scientifique.
Au sein du CERN, une méthode alternative pour l’élimination du technétium 99 a été démontrée avec succès. Il s’agit de la transmutation nucléaire. Elle consiste à bombarder une cible métallique de technétium 99 avec des neutrons afin de produire du 100Tc. Cette substance radioactive a une durée de vie de 16 secondes et se désintègre rapidement en ruthénium (100Ru) par radioactivité bêta.
La production complexe du technétium
Pour obtenir du ruthénium utilisable, il est nécessaire d’avoir une cible de technétium extrêmement pure, sans traces d’actinides mineurs tels que l’américium et le curium. En effet, ces substances peuvent subir une fission et créer des produits de fission qui augmentent la radioactivité de la cible irradiée. Lors de la fresh fission, la formation de 106Ru qui a une demi-vie de 374 jours peut augmenter l’activité du ruthénium métallique obtenu, nécessitant un temps de refroidissement prolongé après l’irradiation.
La production de technétium 99 à partir de combustible nucléaire usé est un processus complexe et chronophage. Ce radioisotope se trouve dans les déchets liquides hautement radioactifs. Après une période de plusieurs années, l’extraction des isotopes à longue durée de vie, tels que le technétium 99, peut être envisagée lorsque la radioactivité a suffisamment décru. Des procédés d’extraction chimique sont ensuite utilisés pour obtenir du technétium métallique de haute pureté, le séparant ainsi chimiquement du combustible appauvri provenant des réacteurs.
Le réacteur national de recherche universel des Laboratoires nucléaires de Chalk River, en Ontario, au Canada, est responsable de deux tiers de la production mondiale de 99Tc.
Production par activation neutronique
L’isotope 99mTc est un élément métastable généré à partir de la fission de l’uranium ou du plutonium dans les réacteurs nucléaires. Dans la gestion classique des déchets nucléaires, le combustible usé est entreposé pendant une longue période avant d’être retraité. Cette approche garantit que tous les isotopes radioactifs, tels que le 99Mo et le 99mTc, se soient décomposés avant d’être séparés des actinides majeurs. Le concentré de raffinement PUREX contient une quantité importante de technétium qui se trouve sous forme de TcO4−. Cependant, il s’agit majoritairement de l’isotope 99Tc.
La production de 99mTc en médecine repose principalement sur la production de 99Mo par activation neutronique de 98Mo. Le 99Mo a une demi-vie de 67 heures qui entraîne la production continue de 99mTc d’une demi-vie de 6 heures par sa désintégration.
Dans les établissements hospitaliers, le technétium est extrait d’une solution grâce à un procédé chimique impliquant l’utilisation d’un générateur de technétium 99m. Ce dispositif est également connu sous le nom de « vache à technétium » ou de « molybdène cow ». Le générateur standard est composé d’une colonne en alumine qui renferme du molybdène 98.
Étant donné que l’alumine a une faible section efficace pour les neutrons, il est facile d’irradier la colonne avec des neutrons pour produire du molybdène 99 radioactif.
L’irradiation de l’uranium enrichi est une méthode alternative pour produire du 99Mo. Toutefois, pour extraire le molybdène des autres éléments de fission, il est nécessaire d’utiliser un procédé chimique complexe qui n’est pas requis dans la première méthode.
Les autres isotopes du technétium ne sont pas produits en quantité significative par fission. Au besoin, ils sont créés par l’irradiation de neutrons sur des isotopes préexistants. Par exemple, le 97Tc peut être produit en irradiant le 96Ru.
Utilisations du technétium
Utilisation en médecine
L’isotope du technétium 99m présente un grand intérêt dans le domaine médical pour ses émissions radioactives lors de sa désintégration. Leur longueur d’onde est similaire à celle des rayons X utilisés en radiographie conventionnelle. Cette caractéristique assure une profondeur de pénétration appropriée tout en limitant les dommages causés par les photons gamma.
En raison de sa courte demi-vie, l’isotope Tc-99m est rapidement éliminé du corps avant de subir une nouvelle désintégration. Une propriété renforcée par la demi-vie plus longue de son isotope fils, le Tc-99. Ceci permet de procéder à un diagnostic nucléaire en administrant une faible dose de radiation, mesurée en sievert, dans l’organisme.
Par ailleurs, l’isotope radioactif 99mTc est fréquemment utilisé comme marqueur en imagerie médicale nucléaire pour plusieurs raisons. Tout d’abord, sa demi-vie de six heures est suffisamment longue pour permettre une observation adéquate des processus physiologiques, tout en étant assez courte pour éviter une irradiation excessive. Ensuite, l’énergie du photon gamma émis (140,5 keV) est optimale pour traverser les tissus vivants tout en étant facilement détectable. Il est possible d’optimiser l’absorption de cette énergie en utilisant un cristal d’iodure de sodium d’une épaisseur de 10 à 15 mm. Enfin, lors de la désintégration, une quantité élevée de photons gamma, de l’ordre 88,5 photons pour 100 désintégrations, est émise. Cette faible émission de particules non pénétrantes réduit l’absorption d’énergie par les tissus vivants.
De plus, ce radioisotope est largement accessible dans les établissements hospitaliers grâce à un petit générateur de technétium de la taille d’une batterie de voiture. Le générateur renferme une colonne d’alumine sur laquelle est adsorbé du molybdène 99 radioactif. Le molybdène subit un processus de désintégration qui conduit à la formation de 99mTc. Ce dernier est récupéré par élution de la colonne dans une solution physiologique telle que le sérum physiologique, sous forme de pertechnétate de sodium (Na+ TcO4−). Le générateur est utilisé pour extraire une solution, appelée éluat, contenant une activité requise pour la préparation des produits utilisés en médecine nucléaire.
Le 99mTc est utilisé pour la cartographie de la distribution de différentes molécules biologiques dans le corps humain en utilisant des dispositifs de détection de radioactivité appelés gamma-caméras. Il trouve également son utilité dans la localisation du ganglion sentinelle, notamment dans le traitement chirurgical du cancer du sein.
En outre, on l’utilise sous forme de technétium-méthoxyisobutylisonitrile (Tc-MIBI) pour le marquage et la scintigraphie tomographique des cellules du muscle cardiaque. Cette méthode permet de déceler la présence de tissus myocardiques non irrigués. La ventriculographie l’utilise sous forme de pertechnétate de sodium pour marquer les globules rouges. L’objectif consiste à évaluer la fonction cardiaque en mesurant des paramètres tels que le volume d’éjection et la fraction d’éjection. En outre, le technétium combiné à la molécule vectrice HDP ou le HMDP constitue l’élément de base dans la scintigraphie osseuse.
La molécule synthétique HMPAO, également connue sous le nom d’hexa-méthyl-propylène-amine-oxime, peut être marquée par cet isotope radioactif. Lorsqu’il est injecté par voie intraveineuse, l’HMPAO se lie au cerveau de manière proportionnelle au débit sanguin cérébral. Ainsi, il est possible d’estimer le débit sanguin dans différentes zones du cerveau en mesurant la quantité de la molécule qui y est fixée.
Applications industrielles et chimiques
Le technétium 99 subit une désintégration radioactive β qui se traduit par l’émission de particules β de faible énergie, sans toutefois produire de rayons γ. Sa longue demi-vie garantit une diminution lente de son taux d’émission au fil du temps. De plus, il est possible de l’extraire avec une pureté chimique et isotopique élevée à partir de déchets radioactifs. En raison de ses propriétés, il est fréquemment choisi comme source d’émission de particules β pour la calibration des équipements du NIST.
Il trouve également des applications en optoélectronique ainsi que dans la conception de batteries nucléaires de taille nanométrique. En tant que catalyseur, il s’avère efficace pour certaines réactions, notamment la déshydrogénation de l’alcool isopropylique, surpassant même le palladium et le rhénium. Toutefois, sa radioactivité se présente comme un obstacle majeur à son utilisation.
Dans certains cas, une faible concentration (5×10−5 mol/L) d’ion pertechnétate dans l’eau peut jouer un rôle d’agent protecteur contre la corrosion de l’acier et du fer. Des observations ont démontré qu’un échantillon immergé dans une solution de pertechnétate peut demeurer intact pendant une période de 20 ans sans être affecté par la corrosion. En comparaison, l’ion chromate CrO42− peut avoir un effet inhibiteur sur la corrosion, mais cela nécessite des concentrations dix fois plus élevées. Ainsi, le pertechnétate a été suggéré comme un inhibiteur potentiel de la corrosion anodique.
Le mode d’action du pertechnétate dans la prévention de la corrosion n’est pas entièrement élucidé, mais il est probablement dû à la formation d’une fine couche à la surface de l’échantillon qui se développe de manière réversible.
Selon une hypothèse, le pertechnétate réagit avec l’acier pour former une couche de dioxyde de technétium à sa surface, prévenant ainsi la corrosion. Cette propriété est également utile pour le retirer de l’eau en utilisant du charbon actif ou de la poudre de fer dans le processus de filtrage. Cependant, la présence d’autres ions en concentration élevée peut compromettre l’efficacité du pertechnétate. De plus, une concentration adéquate doit être maintenue pour que l’effet perdure.