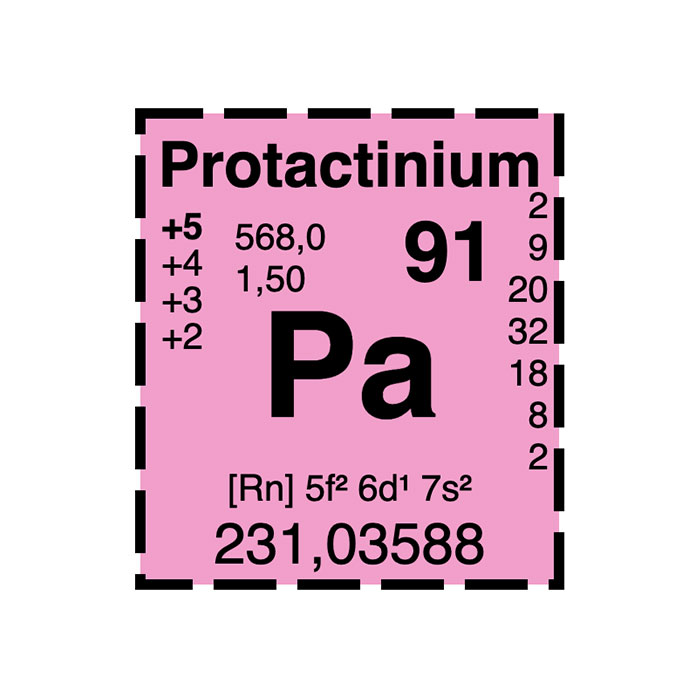
Isotopes
29 isotopes du protactinium ont été pratiquement reconnus. Parmi eux, les plus stables sont :
- 231Pa avec une demi-vie de 32 760 ans ;
- 233Pa avec une demi-vie de 26 967 jours ;
- 230Pa avec une demi-vie de 17,4 jours.
Les autres isotopes n’ont qu’une durée de demi-vie inférieure à 1,6 jour.
Le protactinium dispose de deux isomères peu stables. Le premier est 217mPa avec une demi-vie de 1,15 milliseconde, et le second est 234mPa avec une demi-vie de 1,17 minute.
Les isotopes 231Pa et 234Pa sont associés à la chaîne de désintégration radioactive de l’uranium.
- La chaîne de désintégration β− du thorium 231 fait ressortir l’isotope 231Pa :
23592U ⟶ 23190Th + 42He ;
23190Th ⟶ 23191Pa + e− + ‾νe.
- La chaîne de désintégration β− du thorium 234 donne comme résultat l’isotope 234mPa :
23892U ⟶ 23490Th + 2234He;
23490Th ⟶ 234m91Pa + e− + ‾νe.
‾ve indique l’antineutrino électronique.
Le protactinium paraît très radiotoxique en cas d’ingestion et d’inhalation à cause de son rayonnement α très élevé. Il atteint des valeurs supérieures à celles du plutonium 238. À cause de cette toxicité, l’homme ne doit pas entrer en contact direct avec cet élément chimique.
Gisements
Parmi les éléments naturels, le protactinium est l’un des plus chers et des plus rares. Il se présente en très faible quantité à la surface de la Terre. Sa teneur est de 1 partie par million dans les minéraux qui renferment de l’uranium ou du thorium. Il se forme à partir de la décroissance radioactive de l’uranium. Il n’existe pas à l’état naturel, il est donc intégralement artificiel.