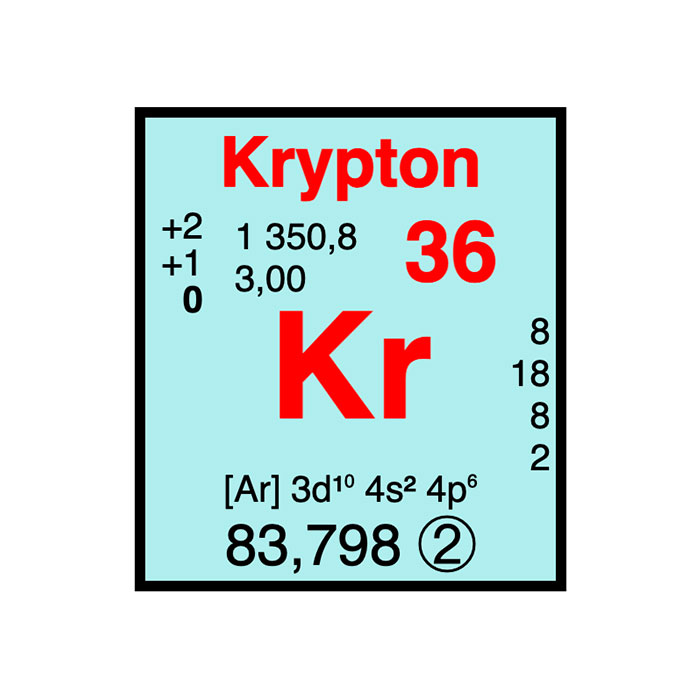
- Symbole : Kr
- Numéro atomique : 36
- Groupe : 18
- Période : 4
- Bloc : p
- Configuration électronique : 3d10 4s2 4p6
- Électrons par niveau d’énergie : 2, 8, 18, 8
- Masse atomique : 83,798 ± 0,002 u
- État ordinaire : Gaz non magnétique
- Masse volumique : 3,733 g/L (0 °C)
- Énergie de fusion : 1 638 kJ/mol
- Énergie de vaporisation : 9,08 kJ/mol (1 atm, -153,34 °C)
- Température critique : -63,67 °C
- Conductivité thermique : 9,49 x 10-3 W/m/K
Le krypton compte 33 isotopes enregistrés ayant un nombre de masses allant de 69 à 101. Seuls quatre sont stables (A = 82, 83, 84, 86) avec un pourcentage respectif de 11,6 %, 11,5 %, 57 % et 17,3 %. Les restes sont des radioisotopes avec des demi-vies allant de moins d’une minute à moins de cinq heures, à l’exception de quelques-uns. Le 81Kr compte notamment une demi-vie de 229 000 années, 10,7 ans pour le 85Kr, 35 h pour 79Kr et 14,8 h pour 76Kr.
Un fait notable de l’isotope 86Kr est que la longueur d’onde de sa raie spectrale permit de définir avec précision la valeur du mètre dans les années ’60 à ‘83. Un mètre serait égal à 1 650 763,73 fois cette mesure dans le vide.
Dérivés du krypton
Bien qu’étant un gaz inerte, le krypton peut, sous des conditions extrêmes, telles qu’une matrice cryogénique ou un jet gazeux supersonique, se combiner à d’autres atomes. Le seul et premier composé officiellement reconnu du krypton est le difluorure de krypton (KrF2). Il a été identifié pour la première fois en 1963 par les chimistes britanniques Neil Bartlett et Derek Dyer MacKenzie en utilisant la radiation ionisante. Turner et Pimentel réussissent également à produire le même produit par photolyse d’un mélange solide de fluor et de krypton dans une matrice d’argon à -235 °C. Le difluorure de krypton constitue un puissant agent fluorant, notamment du xénon et de l’iode. Le KrF+ est le seul agent oxydant connu de l’or.
D’autres dérivés du krypton comme les oxydes et les fluorures de krypton ont été découverts, mais leur instabilité en dehors de conditions strictes ne permet pas de les reconnaître comme tels. Certains composés krypton-azotes auraient notamment été synthétisés à moins de -60 °C et d’autres avec de l’oxygène à moins de -90 °C.