En plus des muscles, le foie et les reins agissent également en tant que réserves de glucose, disponibles pour les autres cellules. Pendant le sommeil, celles de la médullosurrénale et des érythrocytes y puisent leur énergie.
La teneur en glycogène hépatique dépend de l’état nutritionnel de chaque personne. Cette proportion représente moins de 1 % du poids total du foie en cas de jeûne. Elle peut atteindre les 20 % avec une alimentation équilibrée en protéines et en lipides, en plus d’être riche en glucides.
Applications du glycogène
Dans le contexte sportif, les athlètes d’endurance peuvent faire face à l’épuisement de leurs réserves de glycogène. Afin de pallier cette situation, ils adoptent des stratégies telles que l’absorption continue de sucres à indice glycémique élevé pendant l’effort. En effet, une consommation excessive d’aliments sucrés peut favoriser une augmentation de la capacité de stockage des muscles. A titre d’exemple, les cyclistes professionnels recourent à l’ingestion de glucides et de caféine après un entraînement intensif pour reconstituer rapidement leurs réserves.
En cas de dette glycogénique, les athlètes peuvent ressentir une fatigue extrême pouvant aller jusqu’à l’incapacité de mouvement.
Les principaux sites d’accumulation du glycogène dans le corps sont les cellules hépatocytes et les fibres musculaires. Le foie peut amasser 10 % de son poids, tandis que les muscles peuvent stocker jusqu’à 2 %. Étant plus volumineux, ils ont une plus grande capacité de concentration en énergie.
La connaissance du métabolisme de cet amidon de foi est essentielle pour les sportifs afin d’adopter une stratégie de recharge, visant à maximiser leurs stocks énergétiques. Trois jours avant l’épreuve, un entraînement intensif peut épuiser entièrement les réserves de glycogène. Ainsi, il est crucial d’absorber un gramme de glucides par kilogramme de poids toutes les heures pendant quatre heures, pour les renouveler régulièrement.
La consommation de glucose par les muscles dépend de l’intensité et de la durée de l’exercice. Un sportif qui s’alimente optimalement possède généralement suffisamment une réserve de glycogène pour une heure à une heure trente.
Adopter une stratégie pour reconstituer les réserves énergétiques avant l’effort est recommandée, afin de retarder l’apparition de la fatigue. L’entraînement régulier est également important pour améliorer les performances et augmenter naturellement les taux de cette macromolécule dans les muscles.
Pendant l’exercice, les muscles exploitent le glucose pour produire de l’énergie. Lors d’un effort prolongé, un apport en cet élément est vivement recommandé pour fournir du tonus directement aux muscles. Il réduit ainsi l’utilisation des réserves de glycogène. Son épuisement peut occasionner une fatigue musculaire, une baisse de performance, voire des crampes musculaires.
Dans l’ensemble, le sportif doit absorber dix grammes de glucides par kilogramme de poids. Cette quantité est consommée entre les quatre heures post-entraînement et les repas équilibrés de la journée. Cette pratique vise à augmenter les stocks énergétiques pour améliorer les performances dans les sports d’endurance comme le triathlon ou les raids.
Le Régime Dissocié Scandinave (RDS) et le Régime Dissocié Modifié (RDM) sont indiqués pour la recharge glucidique. Le RDS épuise initialement les réserves en glycogène avec un régime pauvre en glucides, mais riche en lipides et en protéines, suivi d’une recharge intense. Le RDM, moins contraignant, se concentre uniquement sur la période de recharge glucidique trois jours avant la compétition.
L’hydratation est cruciale, surtout pendant les épreuves sportives, car lors de la conversion du glucose, un gramme de glycogène nécessite trois grammes d’eau.
Métabolisme du glycogène
Le métabolisme de cette macromolécule est fait de cascades de réactions complexes, finement régulées.
Synthèse du glycogène
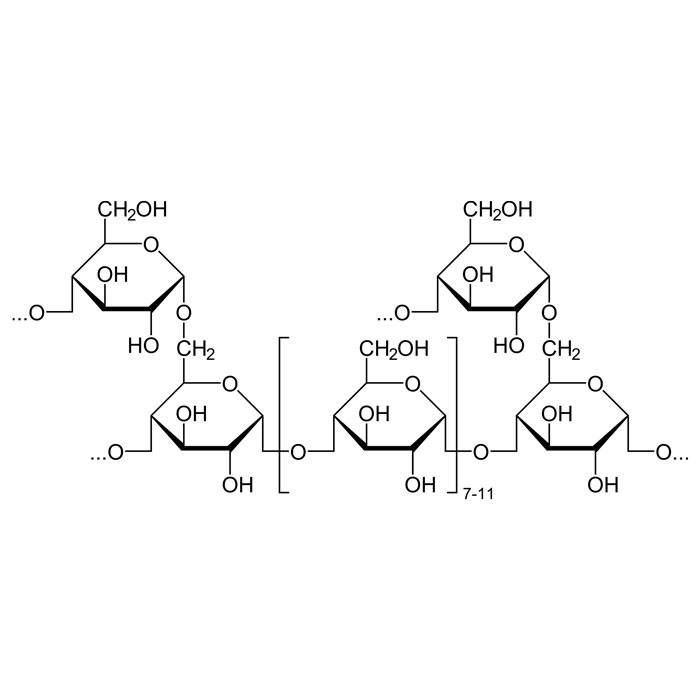
La glycogénogenèse se déroule en deux étapes distinctes. Initialement, la glycogène synthétase facilite la création de chaînes linéaires à partir de l’amorce formée par le glycogénine, présente dans chaque molécule de glycogène. Ces liaisons adoptent la forme α-1,4-D-glucane-osidiques. Par la suite, l’enzyme branchant (α-1,4-D-glucane) interconnecte ces chaînes entre elles.
Le glucose est préalablement phosphorylé pour faciliter son métabolisme et ses transformations avant d’intégrer les réserves d’énergie. L’enzyme phosphoglucomutase isomérise le glucose-6-phosphate en glucose-1-phosphate, est activé ensuite par l’uridine triphosphate. Sous l’action de la glycogène synthase, le glucose ainsi obtenu est ajouté à l’extrémité non réductrice du glycogène existant.
L’enzyme du 1,4-α-glucane crée des subdivisions dans la chaîne toutes les 7 à 12 molécules de glucose. Une structure hautement ramifiée se forme. Le foie et les muscles stockent la macromolécule, ensuite dégradée lors d’un besoin énergétique.