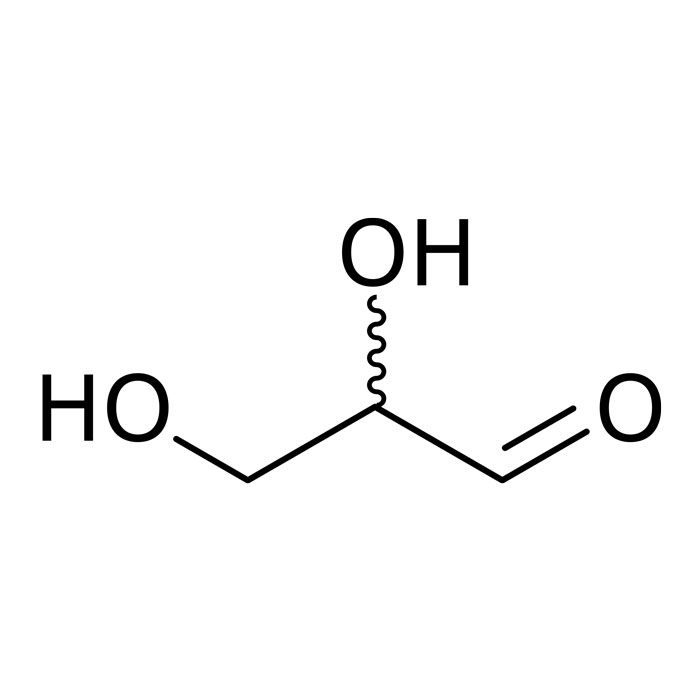
Caractéristiques du glycéraldéhyde
-
Identification du glycéraldéhyde :
- Nom UICPA : 2,3-dihydroxypropanal
- Synonymes : Glycérose
- N° CAS : 367-47-5
- N° ECHA : 100.000.264
- N° CE : –
- Code ATC : –
- PubChem : –
- ChEBI : –
- FEMA : –
- SMILES :–
- InChl : –
Propriétés chimiques :
- Formule : C3H6O3
- Masse molaire : 90,077 9 ± 0,003 7 g/mol (C : 40 %, H : 6,71 %, O : 53,29 %,)
- pKa : –
Propriétés physiques :
- T° Fusion : 145 °C
- Solubilité : –
Propriétés biochimiques :
- Codons : –
- pH isoélectrique : –
- Acide aminé essentiel : –
- Occurrence chez les vertébrés : –
Propriétés optiques :
- Pouvoir rotatoire : –
Précautions :
- SIMDUT : –