Historique des acides dicarboxyliques
Les acides dicarboxyliques n’ont pas été découverts par un seul scientifique. Ils ont été décrits progressivement par plusieurs chercheurs au fil du temps. Ces composés sont nombreux, mais seuls les historiques de quelques-uns seront abordés.
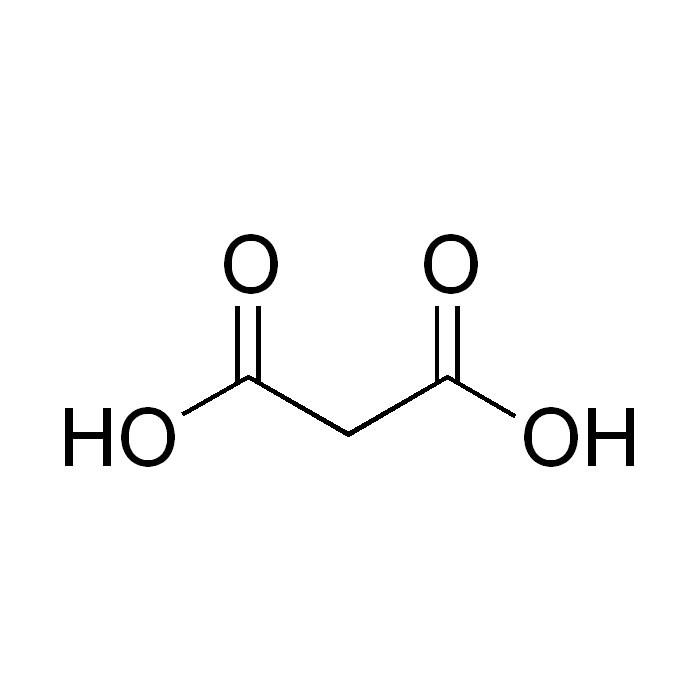
L’acide malonique
L’acide malonique se distingue par une chaîne carbonée à trois atomes, reliée à deux groupements carboxyles. Autrement appelée acide propanedioïque, sa formule chimique est HOOC-CH2-COOH. Il fut découvert vers le milieu du XIXe siècle. Des études sur l’oxydation de jus de pomme ont permis d’isoler et d’identifier cette nouvelle substance dicarboxylique.
La dégradation des sucres contenus dans cette boisson a abouti à la formation d’un dérivé malonique. En 1858, l’acide malonique fut isolé pour la première fois à partir des sous-produits de ce processus d’oxydation. Il a été identifié comme un diacide aliphatique à trois atomes de carbone.
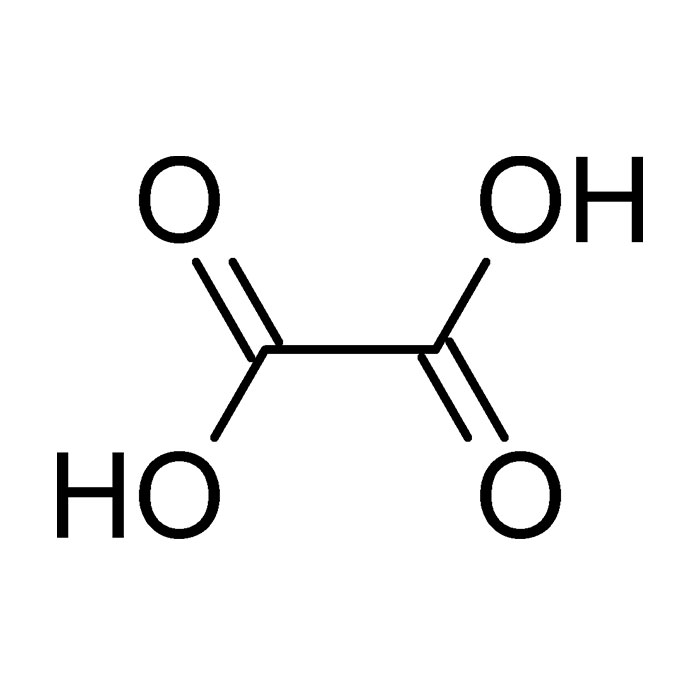
L’acide oxalique
L’acide oxalique est le plus simple des acides dicarboxyliques aliphatiques. Sa structure est constituée de deux fonctions reliées par un groupement méthylène. Sa découverte date de la fin du XVIIIe siècle. Le chimiste suédois Carl Wilhelm Scheele était parvenu à l’isoler à partir de plantes telles que l’oseille ou la rhubarbe. Il avait appliqué une méthode similaire à celle employée pour extraire d’autres acides.
Par la suite, ce scientifique a démontré qu’il s’agissait bien du même composé que celui dénommé à l’époque « acide du sucre » ou « acide saccharin ». Quelques décennies plus tard, en 1824, Friedrich Wöhler réussit à le synthétiser. Il confirme ainsi sa nature organique à une époque pendant laquelle la frontière entre matières organiques et inorganiques n’était pas encore clairement établie.
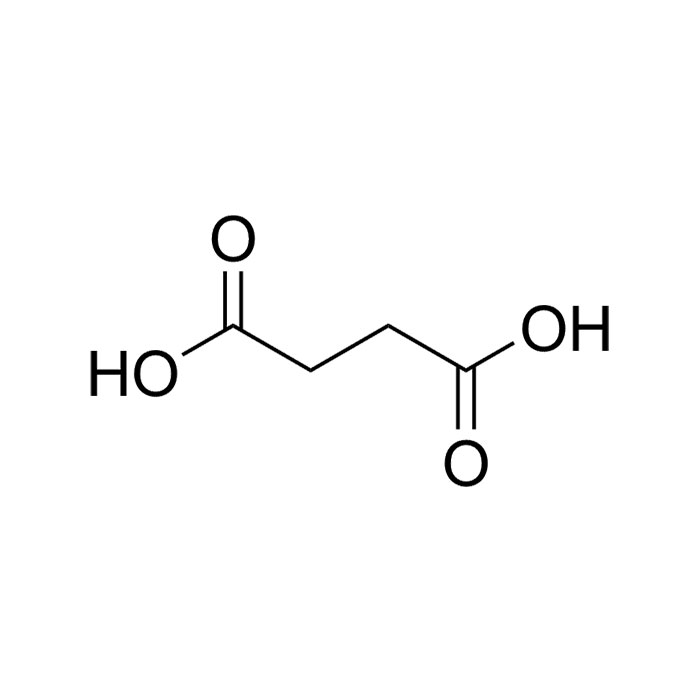
L’acide succinique
L’acide succinique doit son nom à sa découverte initiale dans une substance naturelle nommée ambre jaune ou succin. Dès le XVIe siècle, l’érudit Georgius Agricola est parvenu à l’isoler par chauffage. Connue aussi sous le nom d’acide butanedioïque, cette molécule à quatre carbones est produite de façon endogène par de nombreux végétaux et animaux. Elle peut ainsi être extraite des tissus de la rate de bœuf ou bien de liquides physiologiques tels que les urines. Certaines plantes en produisent également, comme la laitue vireuse ou la grande chélidoine. Son processus de formation étant à base de matière organique, le lignite en contient.